परमाणु
पदार्थ का सबसे छोटा और अविभाज्य कण, जिसमें उस पदार्थ के सभी विशिष्ट गुण होते हैं, परमाणु कहलाता है।
परमाणु यानी ATOM में “Tomos” एक ग्रीक शब्द है, जिसका अर्थ है “काटना”। इस ग्रीक शब्द “टॉमोस” में उपसर्ग “ए” है, जिसका अर्थ है नहीं। यानी “ए-टॉमोस” (अविभाज्य) का पूरा अर्थ अविभाज्य है।
किसी तत्व की सबसे छोटी इकाई जो अपनी स्वतंत्र अवस्था में नहीं पाई जाती है लेकिन रासायनिक अभिक्रिया में भाग ले सकती है, परमाणु कहलाती है। परमाणु शब्द का अर्थ है अविभाज्य जिसे तोड़ा न जा सके । यह शब्द डाल्टन ने सबसे पहले दिया था इसलिए कहा जाता है की परमाणु की खोज डाल्टन ने की थी |
अधिकांश तत्वों के परमाणु प्रकृति में स्वतंत्र अवस्था में नहीं पाए जाते हैं। चूंकि परमाणु अत्यधिक प्रतिक्रियाशील होते हैं, अधिकांश तत्वों के परमाणु प्रकृति में यौगिकों के रूप में पाए जाते हैं।
परमाणुओं के उदाहरण: हाइड्रोजन परमाणु, ऑक्सीजन परमाणु, नाइट्रोजन परमाणु, क्लोरीन परमाणु आदि।
परमाणुओं का आकार ( Size of an atom )
परमाणु इतने छोटे होते हैं कि उन्हें नग्न आंखों से नहीं देखा जा सकता है। बल्कि परमाणुओं का आकार इतना छोटा होता है कि उन्हें साधारण सूक्ष्मदर्शी से भी नहीं देखा जा सकता।
परमाणु गोलाकार होता है। चूँकि परमाणु गोलाकार होता है, इसलिए परमाणुओं का आकार उसकी त्रिज्या के आधार पर तय किया जाता है या परमाणुओं का आकार उसकी त्रिज्या को मापकर तय किया जाता है।
परमाणुओं की त्रिज्या नैनोमीटर में मापी जाती है। नैनोमीटर मीटर की सबसे छोटी इकाई है।
परमाणु कैसे पाए जाते हैं
अधिकांश तत्वों के परमाणु अत्यधिक प्रतिक्रियाशील होते हैं, जिसके कारण ये परमाणु प्रकृति में स्वतंत्र रूप से नहीं होते हैं। बल्कि, अत्यधिक प्रतिक्रियाशील होने के कारण, परमाणु अणुओं, आयनों और यौगिकों के रूप में पाए जाते हैं।
यानी परमाणु अणु, आयन और यौगिक बनाते हैं। ये अणु या आयन बड़ी संख्या में एकत्रित होकर पदार्थ बनाते हैं जिसे हम देख, महसूस या स्पर्श कर सकते हैं।
उदाहरण:
ऑक्सीजन परमाणु अत्यधिक प्रतिक्रियाशील होते हैं। अत्यधिक प्रतिक्रियाशील होने के कारण, ऑक्सीजन परमाणु अधिकांश तत्वों के साथ मिलकर यौगिक बनाते हैं।
डाल्टन का परमाणु सिद्धांत
डाल्टन के अनुसार परमाणु को न तो निर्मित किया जा सकता है और न ही इसको कोई नष्ट कर सकता है। और न ही परमाणुओं को विभाजित किया जा सकता है, वैसे कई तकनीकों के माध्यम से आज यह सब संभव है।
थॉमसन की परमाणु संरचना
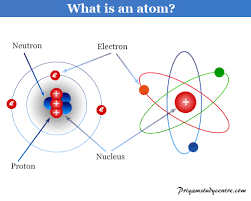
जे. जे. थॉमसन के अनुसार परमाणु एक धन आवेशित गोला है, जिसमें ऋणावेशित कणों को इस प्रकार व्यवस्थित किया जाता है कि पूरा परमाणु उदासीन हो जाता है।
रदरफोर्ड की परमाणु संरचना
रदरफोर्ड के अनुसार, एक परमाणु में एक नाभिक होता है, जिसमें परमाणु का कुल द्रव्यमान और कुल धनात्मक आवेश केंद्रित होता है। ऋणावेशित कण इलेक्ट्रॉन नाभिक के चारों ओर विभिन्न कक्षाओं में चक्कर लगाते हैं। परमाणु के आयतन की तुलना में नाभिक का आयतन नगण्य होता है।
परमाणु की त्रिज्या ( radius ) लगभग 10 मीटर तथा नाभिक की त्रिज्या (Radius ) लगभग 10-15 मीटर होती है।
परमाणु नाभिक (atomic nucleus )

परमाणु का वह केंद्र, जिसमें परमाणु का सारा द्रव्यमान और सारा धनात्मक आवेश केंद्रित होता है, परमाणु का केंद्रक या नाभिक कहलाता है।
इसमें दो तरह के कण पाए जाते हैं- न्यूट्रॉन और प्रोटॉन। न्यूट्रॉन चार्जलेस होता है मतलब यह निष्क्रिय होता है , लेकिन प्रोटॉन में +1 यूनिट पॉजिटिव चार्ज होता है।
प्रोटॉन और न्यूट्रॉन के संयोजन को न्यूक्लियॉन कहा जाता है।
सभी नाभिकों के बीच एक आकर्षण बल होता है, जिसे नाभिकीय बल कहते हैं। इस बल के कारण नाभिक में परमाणु का स्थायित्व होता है।
नाभिक में होने वाली अभिक्रिया को नाभिकीय अभिक्रिया कहते हैं, जो दो प्रकार की होती है- नाभिकीय विखंडन और नाभिकीय संलयन।
कक्षा ( Orbit ) – इलेक्ट्रॉन परमाणु के नाभिक के चारों ओर विभिन्न वृत्ताकार पथों में गति करते हैं। इन वृत्ताकार पथों को कक्षाएँ या कोशिकाएँ या ऊर्जा स्तर कहा जाता है।
इन्हें K, L, M, N आदि से दर्शाया जाता है।
एक कक्षक में इलेक्ट्रॉनों की अधिकतम संख्या 2n2 में होती है, जहाँ n कक्षीय संख्या होती है।
कक्षा में इलेक्ट्रोनों की संख्या –
K = 2
L = 8
M = 18
N = 32
किसी परमाणु की अंतिम कक्षा में इलेक्ट्रॉनों की अधिकतम संख्या 8 होती है।
किसी परमाणु की सबसे आखिरी कक्षा से पहले की कक्षा को पेनाल्टिमट कहा जाता है और अंतिम कक्षा से पहले की कक्षा को एंटिपेनल्टीमेट कक्षा कहा जाता है।
उप-कक्षा – एक कक्षा के विभिन्न भाग होते हैं। इन भागों को उपवर्ग कहा जाता है। ये S P D F आदि द्वारा दर्शाए जाते हैं।
K-वर्ग में एक उपवर्ग होता है-
L-ऑर्बिट में दो सब-ऑर्बिटल्स होते हैं- s और p
M – क्लास में तीन वर्ग हैं – एस, पी और डी।
N-वर्ग में चार उप-वर्ग होते हैं- s, p, d और f
इलेक्ट्रॉनों की अधिकतम संख्या S-शेल में 2, p-शेल में 6, d-शेल में 10 और f-शेल में 14 है।
परमाणु द्रव्यमान (atomic mass )
डाल्टन के परमाणु सिद्धांत की सबसे प्रमुख अवधारणा परमाणु द्रव्यमान की थी। डाल्टन के परमाणु सिद्धांत के अनुसार, प्रत्येक तत्व का एक विशिष्ट परमाणु द्रव्यमान होता है।
परमाणु द्रव्यमान का निर्धारण
परमाणु का द्रव्यमान ज्ञात करना अपेक्षाकृत कठिन कार्य था, इसलिए सापेक्ष परमाणु द्रव्यमान रासायनिक संयोजन द्वारा निर्मित यौगिकों के माध्यम से निर्धारित किए जाते थे।
परमाणु द्रव्यमान की इकाई
परमाणु द्रव्यमान को अंग्रेजी में परमाणु द्रव्यमान इकाई कहते हैं, जिसका संक्षिप्त नाम ‘अमु’ है। इसलिए, शुरू में परमाणु द्रव्यमान के अंग्रेजी नाम के लिए संक्षिप्त नाम ‘अमु’ का इस्तेमाल परमाणु द्रव्यमान के रूप में किया गया था।
लेकिन इंटरनेशनल यूनियन ऑफ प्योर एंड एप्लाइड केमिस्ट्री [आईयूपीएसी (इंटरनेशनल यूनियन ऑफ प्योर एंड एप्लाइड केमिस्ट्री)] की मंजूरी के बाद परमाणु द्रव्यमान की इकाई के लिए प्रतीक के रूप में केवल ‘यू’ का इस्तेमाल किया जा सकता है। डाल। ‘यू’ का अर्थ है ‘एकीकृत द्रव्यमान’
प्रारंभ में, सापेक्ष परमाणु द्रव्यमान की गणना के लिए, ऑक्सीजन को मानक के रूप में लिया गया था और ऑक्सीजन परमाणु के द्रव्यमान के 116-116 को इकाई के रूप में लिया गया था क्योंकि
(ए) यौगिक बनाने के लिए ऑक्सीजन कई तत्वों के साथ प्रतिक्रिया करता है।
(बी) इस परमाणु द्रव्यमान इकाई द्वारा, अधिकांश तत्वों के परमाणु द्रव्यमान को गोलाकार किया जाता है।
लेकिन बाद में 1961 में, परमाणु द्रव्यमान इकाई ‘कार्बन-12’ आइसोटोप को सार्वभौमिक रूप से परमाणु द्रव्यमान निर्धारित करने के लिए मानक संदर्भ के रूप में स्वीकार किया गया था।
कार्बन-12 समस्थानिक के द्रव्यमान के 112112वें भाग को सापेक्ष परमाणु द्रव्यमान की मानक इकाई माना जाता था।
यानी एक परमाणु द्रव्यमान या ‘1 u’ = ‘कार्बन-12’ के द्रव्यमान का 112112वां
या, ‘कार्बन-12’ के द्रव्यमान का 1 u1 u = 112112वां
इसका अर्थ है, (1) यदि हाइड्रोजन का परमाणु द्रव्यमान 1 u1u है तो हाइड्रोजन का एक परमाणु ‘कार्बन-12’ के एक परमाणु के 12वें भाग से 1 गुना भारी है।
(2) ऑक्सीजन का परमाणु द्रव्यमान 16 है। इसका अर्थ है कि ऑक्सीजन का एक परमाणु ‘कार्बन-12’ के एक परमाणु के 12वें भाग से 16 गुना भारी है।
(2) नाइट्रोजन का परमाणु द्रव्यमान 14 है। इसका अर्थ है कि नाइट्रोजन का एक परमाणु ‘कार्बन-12’ के एक परमाणु के 12वें भाग से 14 गुना भारी है।
इसलिए, परमाणुओं के द्रव्यमान की गणना ‘कार्बन-12’ समस्थानिक के द्रव्यमान के सापेक्ष की जाती है।
