रासायनिक अभिक्रियाओं में अणुओं के बीच बंधों के बनने और टूटने से नए पदार्थ बनते हैं। इसमें पुराने बंधन टूटते हैं और नए बनते हैं। अभिक्रिया होने के लिए सबसे पहले ऊर्जा की आवश्यकता होती है। अभिकर्मक के अणुओं को पर्याप्त रूप से संपर्क करने के लिए हिलाकर ऊर्जा किसी भी रूप में दी जा सकती है जैसे गर्मी, प्रकाश, बिजली या यांत्रिक ऊर्जा। जब रासायनिक प्रतिक्रियाएं होती हैं, तो परमाणुओं को कई तरह से पुनर्व्यवस्थित किया जा सकता है। उदाहरण के लिए, पानी के अणुओं के टूटने से ऑक्सीजन और हाइड्रोजन पैदा होते हैं, जबकि कार्बन और ऑक्सीजन के बीच का बंधन कार्बन डाइऑक्साइड देता है।
क्या आप जानते हैं कि दैनिक जीवन में भी रासायनिक प्रतिक्रियाएं होती हैं जैसे भोजन का पाचन, दूध का फटना, फलों का पकना, अंगूर का शराब बनाने के लिए किण्वन आदि। सांस लेना भी एक रासायनिक अभिक्रिया है |
भौतिक परिवर्तन – वह परिवर्तन जिसमें पदार्थ के भौतिक गुण बदलते हैं लेकिन रासायनिक गुणों में कोई परिवर्तन नहीं होता है, भौतिक परिवर्तन कहलाता है।
भौतिक परिवर्तन के गुण:-
केवल पदार्थ के भौतिक गुण जैसे अवस्था, आकार आदि में परिवर्तन होता है।
परिवर्तन के कारण को हटाने से प्रारंभिक सामग्री फिर से मिल जाती है।
यह परिवर्तन अस्थायी है।
कोई नई सामग्री नहीं बनती है।
उदाहरण – बल्ब का जलना, नमक को पानी में घोलना, मोम का पिघलना, पानी का वाष्पीकरण, फलों से सलाद बनाना, बर्तन में मक्खन पिघलाना
रासायनिक परिवर्तन –

एक परिवर्तन जिसमें किसी पदार्थ के रासायनिक गुण बदल जाते हैं
लेकिन भौतिक गुणों में कोई परिवर्तन नहीं होता है, इसे रासायनिक परिवर्तन कहते हैं।
रासायनिक परिवर्तन के गुण :-
रासायनिक परिवर्तन के परिणामस्वरूप बनने वाला पदार्थ रासायनिक गुणों और संरचना में मूल पदार्थ से बिल्कुल अलग होता है।
सामान्य तौर पर, प्रारंभिक सामग्री को पुनर्प्राप्त नहीं किया जा सकता है।
यह परिवर्तन स्थायी है।
नए पदार्थ बनते हैं।
उदाहरण – दूध से दही बनना, लोहे में जंग लगना, लोहे और सल्फर से आयरन सल्फाइड, लकड़ी और कागज का जलना
रासायनिक अभिक्रिया की परिभाषा :-
ऐसा परिवर्तन जिसमें नए गुणों वाले पदार्थ बनते हैं, उसे रासायनिक अभिक्रिया कहते हैं या रसायनों से संबंधित अभिक्रिया को रासायनिक अभिक्रिया कहते हैं।
वे पदार्थ जो रासायनिक अभिक्रिया में भाग लेते हैं उन्हे अभिकारक कहा जाता है ।
वे पदार्थ जो रासायनिक अभिक्रिया में बनते है उन्हे उत्पाद कहा जाता है।
उदाहरण :-
भोजन का पाचन
श्वसन
लोहे में जंग लगना
जलती हुई मैग्नीशियम फीता
दूध से दही
खाना पकाने की प्रक्रिया
रासायनिक अभिक्रिया को पहचानने की विधियाँ :-
अवस्था में परिवर्तन
रंग में परिवर्तन
तापमान में परिवर्तन
गैस उत्सर्जन
अवस्था परिवर्तन : रासायनिक अभिक्रिया में अवस्था परिवर्तन होता है। मैग्नीशियम रिबन को ऑक्सीजन की उपस्थिति में जलाने पर मैग्नीशियम पाउडर बनता है।
2Mg + o2 → 2 M g O
रंग में परिवर्तन :- रासायनिक अभिक्रिया में रंग में परिवर्तन होता है। कॉपर सल्फेट के घोल का रंग नीला होता है, लेकिन लोहे की कीलों को मिलाने पर इसका रंग हरा हो जाता है, इसलिए रासायनिक अभिक्रिया में रंग में परिवर्तन होता है।
CuSO4 + Fe → FeSO4 + Cu
तापमान में परिवर्तन :- रासायनिक अभिक्रिया में तापमान में परिवर्तन होता है। जब तनु सल्फ्यूरिक अम्ल में दानेदार जस्ता मिलाया जाता है, तो बर्तन गर्म हो जाता है। इसलिए, प्रतिक्रिया में तापमान में परिवर्तन हुआ।
गैस का उत्सर्जन :- रासायनिक अभिक्रिया में गैस का उत्सर्जन होता है। जब सल्फ्यूरिक एसिड को पतला करने के लिए दानेदार जस्ता मिलाया जाता है तो हाइड्रोजन गैस निकलती है।
रासायनिक प्रतिक्रियाओं के प्रकार-
- संयोजन प्रतिक्रिया
संयोजन का मतलब होता है जुडना
वह अभिक्रिया जिसमें दो या दो से अधिक अभिकारक एक उत्पाद बनाते हैं, संयोजन अभिक्रिया कहलाती है।
X+ Y =XY
उदाहरण: दीवारों को चूने से सफेदी करना। जब पानी में चूना मिलाया जाता है, तो बुझा हुआ चूना बनता है यानी कैल्शियम हाइड्रॉक्साइड और कैल्शियम हाइड्रॉक्साइड हवा में मौजूद कार्बन डाइऑक्साइड के साथ धीरे-धीरे प्रतिक्रिया करके दीवारों पर कैल्शियम कार्बोनेट बनाते हैं। पतली परत बनाता है।
चूना + पानी → बुझा हुआ चूना या कैल्शियम हाइड्रॉक्साइड
Ca(OH)2 + CO2 → CaCO3+ H 2O
कैल्शियम हाइड्रॉक्साइड + कार्बन डाइऑक्साइड → कैल्शियम + वाटर कार्बोनेट
परिभाषा – वह रासायनिक अभिक्रिया जिसमें दो या दो से अधिक पदार्थ मिलकर एक उत्पाद बनाते हैं, संयुग्मन या संयोजन अभिक्रिया कहलाती है।
उदाहरण :-
कोयले का दहन
C(s) + O2 (g) → CO2(g)
जल उत्पादन
2H2(g) + O2(g) → 2H2O(\ell)
(बुझा हुआ चूना) (बुझा हुआ चूना)
मैग्नीशियम रिबन का दहन
2. वियोजन अभिक्रिया
वियोजन का मतलब होता है ‘टूटना’।
परिभाषा – ऐसी रासायनिक अभिक्रिया जिसमें एक अभिकारक टूटकर दो या दो से अधिक उत्पाद बनाता है, अपघटन अभिक्रिया कहलाती है। इसे रासायनिक अभिक्रिया भी कहते हैं।
ऊष्मीय वियोजन
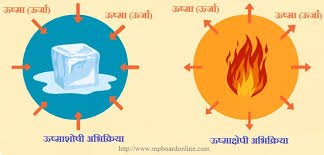
:– ऊष्मा द्वारा किया गया वियोजन।
विद्युत अपव्यय :- विद्युत धारा प्रवाहित होने पर वियोजन।
इलेक्ट्रोलिसिस में, एनोड और कैथोड पर विभिन्न उत्पाद प्राप्त होते हैं। ये यौगिक सामान्यतः आयनिक प्रकृति के होते हैं।
प्रकाशीय वियोजन:- सूर्य के प्रकाश की उपस्थिति में वियोजन होता है।
3. एक्ज़ोथिर्मिक प्रतिक्रिया और एंडोथर्मिक रासायनिक प्रतिक्रिया
उष्माक्षेपी प्रतिक्रिया:
वे अभिक्रियाएँ जिनमें उत्पादों के निर्माण के साथ-साथ ऊष्मा भी निकलती है, ऊष्माक्षेपी अभिक्रियाएँ कहलाती हैं।
उदाहरण :-
सब्जियों और सब्जियों के अपघटन से खाद बनना।
श्वसन की प्रक्रिया।
प्राकृतिक गैस दहन
जल उत्पादन
एंडोथर्मिक प्रतिक्रिया:
वे अभिक्रियाएँ जिनमें अभिकारकों को तोड़ने के लिए ऊष्मा, प्रकाश या विद्युत ऊर्जा की आवश्यकता होती है, ऊष्माशोषी अभिक्रियाएँ कहलाती हैं।
4. बेग के आधार पर रसायनिक अभिक्रिया के प्रकार
रासायनिक अभिक्रियाएँ वेग के आधार पर दो प्रकार की होती हैं अर्थात् लगने वाला समय – धीमी और तीव्र।
(अ) तीव्र प्रतिक्रिया: –
जब अभिकारकों को मिलाया जाता है तो ये अभिक्रियाएँ बहुत तेजी से होती हैं। आम तौर पर ऐसी प्रतिक्रियाएं आयनिक प्रतिक्रियाएं होती हैं, जैसे कि एक मजबूत एसिड और एक मजबूत आधार के बीच की प्रतिक्रिया 10-10 सेकंड में पूरी हो जाती है।
NaOH + HCl → NaCl + H2O (10-10 सेकंड)
AgNO3 + HCl → AgCl + HNO3
सफेद अवक्षेप
सिल्वर नाइट्रेट और हाइड्रोक्लोरिक अम्ल को मिलाने पर सिल्वर क्लोराइड (AgCl) का सफेद अवक्षेप बनता है। पौधों में प्रकाश संश्लेषण की प्रतिक्रिया का आधा जीवन काल 10-12 सेकंड है। [आधे अभिकारकों को उत्पादों में बदलने में लगने वाले समय को प्रतिक्रिया का आधा जीवन कहा जाता है]
(ब) धीमी प्रतिक्रिया
ऐसी कई प्रतिक्रियाएँ होती हैं जिन्हें पूरा होने में घंटों, दिन या साल भी लग जाते हैं, उन्हें धीमी रासायनिक प्रतिक्रियाएँ कहते हैं, जैसे कि लोहे में जंग लगने की प्रक्रिया सालों तक चलती है, जो धीमी रासायनिक प्रतिक्रिया का एक उदाहरण है। .
5. प्रतिवर्ती – अपरिवर्तनीय प्रतिक्रियाएं :-
वह अभिक्रिया जिसमें अभिकारक अभिक्रिया करके उत्पाद बनाते हैं, उसी समय उत्पाद अभिक्रिया करके समान परिस्थितियों में अभिकारक बनाते हैं, उत्क्रमणीय अभिक्रिया कहलाती है।
ये प्रतिक्रियाएं दोनों दिशाओं में होती हैं।
इन अभिक्रियाओं में अभिकारकों की मात्रा कभी भी शून्य नहीं होती है।
अपरिवर्तनीय प्रतिक्रिया
वह अभिक्रिया जिसमें अभिकारक अभिक्रिया करके उत्पाद बनाते हैं लेकिन उत्पाद पुनः अभिक्रिया नहीं करता, अभिकारक बनाता है, अपरिवर्तनीय अभिक्रिया कहलाती है।
6. विस्थापन अभिक्रिया :-
ऐसी रासायनिक अभिक्रिया जिसमें एक अभिकारक में उपस्थित परमाणु या परमाणुओं का समूह दूसरे अभिकारक के परमाणु या परमाणुओं के समूह द्वारा विस्थापित हो जाता है, विस्थापन अभिक्रिया कहलाती है।
या
इन अभिक्रियाओं में जो तत्व अधिक क्रियाशील होते हैं वो कम क्रियाशील तत्व को उसके यौगिक से विस्थापित कर देते है।
कॉपर सल्फेट (CuSO4) के नीले रंग के घोल में लोहे की कील डालने से उसका नीला रंग गायब हो जाता है। लोहे की कील पर एक भूरे रंग की तांबे की परत जमा हो जाती है। CuSO4 के नीले विलयन का हरा रंग FeSO4 के बनने के कारण होता है।
7. द्विविस्थापन रासायनिक अभिक्रिया :-
इस प्रतिक्रिया दो यौगिकों के बीच आयनों के आदान-प्रदान होता है जिसके फलस्वरूप नए उत्पाद का निर्माण होता हैं।
अम्ल और क्षार अभिक्रिया करके लवण और जल बनाते हैं, इसे उदासीनीकरण अभिक्रिया कहते हैं। यह द्विविस्थापन अभिक्रिया है।
8. अवक्षेपन रासायनिक अभिक्रिया :-
द्विविस्थापन अभिक्रिया में, सोडियम सल्फेट और बेरियम क्लोराइड, बेरियम सल्फेट (BaSO4) के साथ एक सफेद अघुलनशील अवक्षेप के निर्माण के साथ प्रतिक्रिया करते हैं, इसलिए इस प्रतिक्रिया को अवक्षेपण प्रतिक्रिया भी कहा जाता है।
9. ऑक्सीकरण :-
(i) जब अभिक्रिया में किसी पदार्थ में ऑक्सीजन की वृद्धि होती है उसे ऑक्सीकरण कहा जाता है ।
(ii) जब किसी पदार्थ में हाइड्रोजन की हानि होती है।
(iii) जिसमें एक परमाणु, आयन या अणु एक इलेक्ट्रॉन खो देता है।
(iv) विद्युत ऋणात्मक तत्वों का संयोजन।
(v) विद्युत धनात्मक तत्वों को हटाना।
उदाहरण :-
(अ) C + O 2 → CO 2
(ब) 2Cu + O2 → 2CuO
(स) 2Mg + O2 → 2 MgO
10.अपचायन रासायनिक प्रतिक्रिया:-
जब कोई पदार्थ ऑक्सीजन खो देता है।
जब किसी पदार्थ में हाइड्रोजन मिलाया जाता है।
यह ऐसी प्रतिक्रिया है जिसमे एक परमाणु, आयन या अणु एक इलेक्ट्रॉन को ग्रहण करते है ।
विद्युत ऋणात्मक तत्वों को हटाना।
विद्युत-समृद्ध तत्वों का संयोजन।
उदाहरण :-
2 Mg + O 2 = 2MgO
11. रेडॉक्स प्रतिक्रिया :-
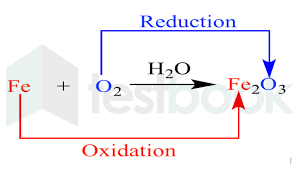
वह अभिक्रिया जिसमें ऑक्सीकरण तथा अपचयन अभिक्रियाएँ साथ-साथ चलती हैं अर्थात् ऑक्सीकरण अभिक्रिया में इलेक्ट्रॉन हट जाते हैं तथा अपचयन अभिक्रिया में इलेक्ट्रॉन लिए जाते हैं, इस अभिक्रिया को रेडॉक्स अथवा रेडॉक्स अभिक्रिया कहते हैं।
ऑक्सीकारक (Oxidizer) :- वह पदार्थ जो अन्य पदार्थों को ऑक्सीकृत करके स्वयं को अपचयित करता है, ऑक्सीकारक कहलाता है।
अपचायक (Reducing) : वे पदार्थ जो अन्य पदार्थों को अपचयित करते हैं और स्वयं ऑक्सीकरण करते हैं, अपचायक कहलाते हैं।
उपरोक्त समीकरण में, CuO का ऑक्सीकरण होता है और H2 का अपचयन होता है।
